トキソプラズマ症は、トキソプラズマ(
Toxoplasma gondii)というアピコンプレクサに属する一属一種の寄生性原生生物(原虫)により起こされる感染症である。トキソプラズマはほぼ全ての温血脊椎動物(哺乳類・鳥類)に感染能を持つ。一度感染すると終生免疫が継続するが、感染率は国・地域・年齢によって異なる。食肉習慣やネコの抗体保有率、衛生状態などが複雑に関連すると考えられる。ブラジル、フランスなどで感染率が高い
1,2)。世界的に見ると全人類の1/3以上(数十億人)が感染しているとされるなど非常に広く蔓延していることが知られている。健常者が感染した場合は、免疫系の働きにより臨床症状は顕在化しないか軽度の急性感染症状を経過した後で、生涯にわたり保虫者となる。しかし、HIV感染患者などの免疫不全者には重篤な症状を引き起こすため、十分な注意が必要である。また、妊娠中の女性が感染することにより起こる先天性トキソプラズマ症は、死産および自然流産だけではなく児に精神遅滞、視力障害、脳性麻痺など重篤な症状をもたらすことがある。
病原体
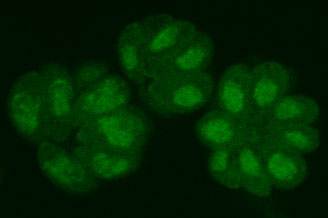 |
| 図1. トキソプラズマ。 |
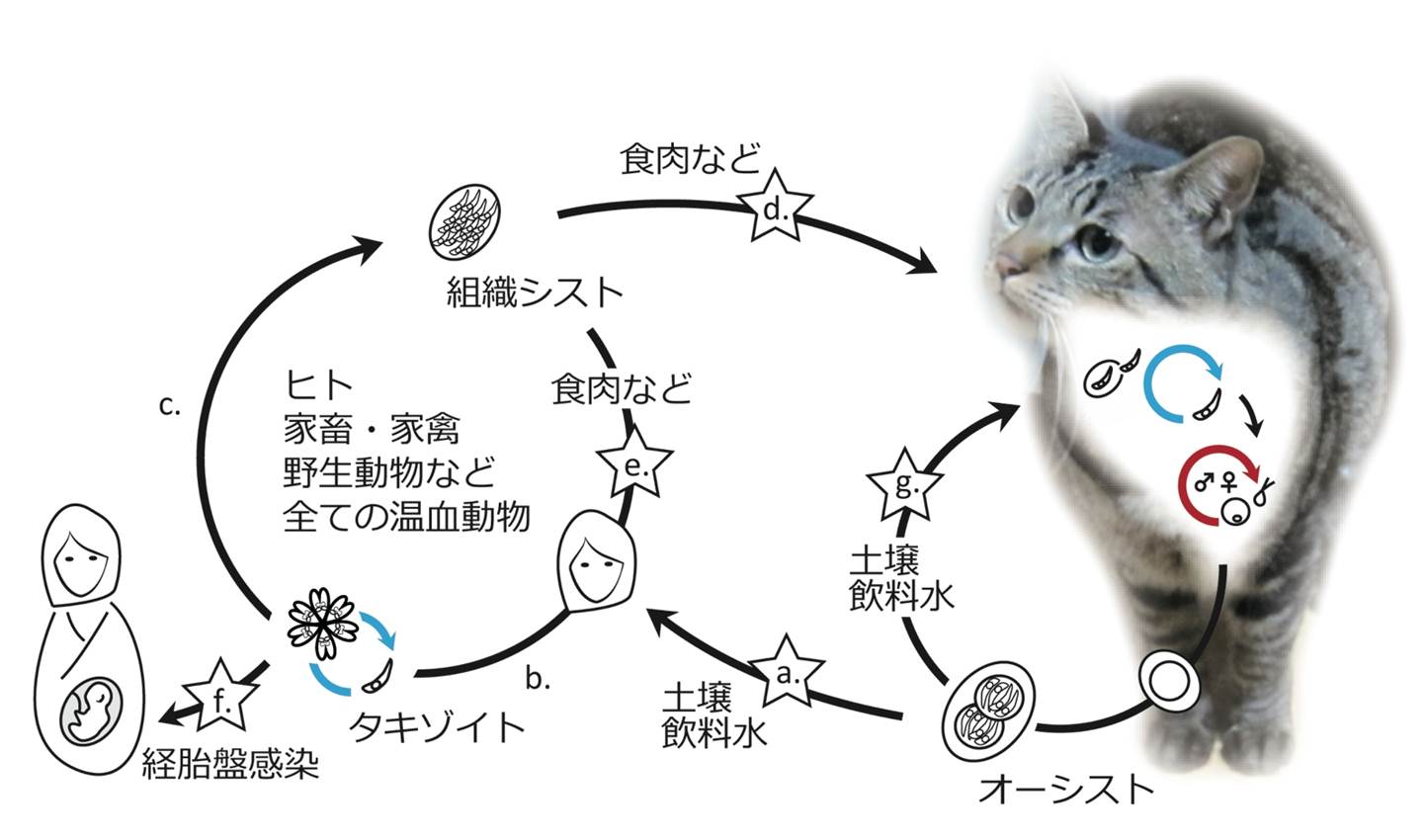 |
| 図2. トキソプラズマの生活環。 |
トキソプラズマは幅3 µm、長さ5-7 µmの半円〜三日月形をした原虫である(
図1)。細胞内寄生性であり、環境中で単独では増殖しない。トキソプラズマの生活環は終宿主内での有性生殖と中間宿主内での無性生殖のステージからなる(
図2)。有性生殖はネコ科動物の腸管上皮内でのみ成立するが、無性生殖はヒトや家畜など全ての温血動物で可能である。
中間宿主への感染は、他の中間宿主組織シストまたは終宿主であるネコ科動物のオーシストを経口摂取することによる。摂取されたトキソプラズマは、消化管壁から中間宿主の細胞内に侵入し、endodiogeny(内生2分裂)とよばれる特徴的な2分裂を行い活発に増殖する。急性感染期に宿主が妊娠中であれば原虫が胎盤を通過して胎児に移行する。宿主側の免疫応答が開始されると、トキソプラズマは中枢神経系や筋肉内で組織シストと呼ばれる構造をとる。組織シストは安定な壁に覆われているため、トキソプラズマは免疫系の攻撃を受けずに生存を続ける。組織シスト内部での原虫増殖は緩やかであり、この時期の原虫をブラディゾイト(緩増虫体)と呼ぶ。ヒトを始めとする中間宿主が感染中間宿主を摂食することに伴い組織シストを経口摂取するとトキソプラズマは新たな宿主内で同様に増殖を開始する。
終宿主であるネコ科動物が感染中間宿主を捕食すると、組織内に存在する組織シストからトキソプラズマは遊離して腸管上皮に侵入する。原虫は数回の無性生殖を行った後、有性生殖により雌性、雄性配偶子を形成する。両者は腸管内部で融合し、未成熟オーシストとして糞便などとともに体外に放出される。未成熟オーシストは一定時間中に分裂し、一つのオーシストの中に8個の虫体が含まれた成熟オーシストとなる。
以上のように、トキソプラズマは他の多くの寄生原虫と同様に、生活史に中間宿主と終宿主の両方を必要とする。一方でトキソプラズマでは、中間宿主-中間宿主の感染が成立するという点が大きな特徴となっており、この形質が本原虫の急速な拡散、遺伝的均一性の増加をもたらしたと考えられている。
図の説明
| 図1: |
GFPを発現しているトキソプラズマ原虫。トキソプラズマは宿主細胞内でエンドダイオジェニーとよばれる独特の2分裂を繰り返し、図のように花びら状に増殖する。 |
| 図2: |
筑波大学大学院
松原立真氏提供。☆は新たな宿主に伝播可能な経路を示す。a)感染はネコ科動物から排出されたオーシストを経口摂取することで生じる。b)オーシストは体内に侵入し、タキゾイトとして活発に増殖する。c)免疫系の活性化に伴い、抵抗性のある組織シストを形成して内部でブラディゾイトに分化する。d)中間宿主を捕食することで、組織シストがネコ科動物に取り込まれると腸管内で有性生殖が起きる。e)組織シストは中間宿主に摂取されると新たな宿主内で再びタキゾイトとなり増殖する。f)妊娠中に初感染すると、経胎盤感染により胎児に先天性トキソプラズマ症を引き起こす。g)伝播は終宿主であるネコ科動物同士でも可能である。青矢印は無性生殖、赤矢印は有性生殖を示す。 |
ヒトへの感染
トキソプラズマのヒトに対する感染は、加熱の不十分な食肉に含まれる組織シスト、あるいはネコ糞便に含まれるオーシストの経口的な摂取により生じる。眼瞼結膜からも感染するが、空気感染、経皮感染はしない。
日本では主な感染源として従来豚肉が重要視されてきた。ブタのトキソプラズマ症の報告について少なくなってきているものの、依然として報告例があり、特に沖縄県においてはむしろ発生数に増加傾向が見られ、注意が必要である
3)。沖縄県においてブタのトキソプラズマ症は、と畜検査における全部廃棄対象疾病の中でもいまだ上位を占めている。ブタに限らずトキソプラズマは全ての温血動物に感染可能であるため、魚介類を除き、哺乳類である鯨を含めた獣肉や鳥肉の生食や加熱不十分は常に感染のリスクを伴う。妊婦もしくはその可能性のある方は、肉の生食は控えるとともに、肉を調理する際には、中心部まで十分に加熱することやまな板を肉用とその他用に分けるなどの対応が必要である。なお、食肉中のシストの不活化には、中心が67℃になるまでの加熱
4)、あるいは中心が-12℃になるまでの凍結
5)が有効であるとされる。電子レンジによる加熱では内部温度の十分な上昇が得られないため必ずしも確実であるとはいえない
6)。なお冷蔵処理では原虫の感染能を排除できないため注意が必要である。
食肉以外にも、近年は水や土壌由来の感染事例が散見され、特に水系伝播ではアウトブレークが報告されるなど、環境からの感染リスクも無視出来ないものとなっている
7-9)。環境からのトキソプラズマ感染は、終宿主であるネコの糞便に含まれるオーシストにより引き起こされる。オーシストは-20 ºCで1ヶ月程度生存可能であることが示され
10)、また次亜塩素酸やエタノールを含む多くの消毒剤が無効であるため注意が必要である。ガーデニングやすな場など土壌との接触、感染したネコとの接触、井戸水、わき水等の無処理の生水の摂取は感染の確率を上昇させる。感染したネコがオーシストを排出するのは、初感染後数日からおよそ2週間までの間のみであり、また、排出されたオーシストが成熟し感染能を獲得するまでに少なくとも24時間を要するとされるため、糞便の処理を毎日(24時間以内で)実施することにより感染力のあるオーシストとの接触を回避できる(このときトイレ容器は熱湯で消毒することが望ましい)。よって、妊娠を理由に飼いネコを処分する必要はないが、猫の糞便の処理は妊婦以外の者が行うことが望ましい。
臨床症状・診断
トキソプラズマの臨床症状は感染時期や感染者の状況に大きく左右される。そこで病型ごとに分けて症状を記載する。また診断は臨床症状と血清診断、遺伝子検査が主なものとなる。最近発表された1997年7月から2004年12月までの約7年半にわたる宮崎県での計4,466例の妊婦の抗体検査による調査結果では、妊婦の抗体保有率は全体で10.3%、35歳以下の若年者で9.6%であることが報告されており
11)、妊娠中の女性や免疫不全者は、感染予防に留意が必要である。
- 先天性トキソプラズマ症
妊娠中の女性がトキソプラズマに初感染した場合、トキソプラズマが胎盤を通過して胎児に垂直感染する可能性がある。胎児への感染率は妊娠末期になるほど上がるが、胎内感染が起こった場合の重症度は妊娠初期ほど高い12)。胎内感染の転帰は、不顕性から流死産まで様々であり、顕性感染の場合でもその重症度は様々である。先天性トキソプラズマ症では、水頭症、脈絡膜炎による視力障害、脳内石灰化、精神運動機能障害が4大徴候として知られている。その他、リンパ節腫脹、肝機能障害、黄疸、貧血、血小板減少等が見られることもある。不顕性感染となった場合も、眼病変などはおおよそ思春期頃まで遅発性の発症のリスクがあるとされている。
妊婦の感染を疑う場合、妊婦の抗体検査(IHA法、LA法など)、IgM抗体検査(ELISA法など)やIgGアビディティ(avidity,結合力)検査で、胎児の感染リスクを評価する。高リスクの場合は、羊水から原虫遺伝子をPCR法により検出することにより胎児感染診断を試みることがあるが、確実な方法ではない。出生後の診断のためには移行抗体消失後に児の血清検査を行う。IgGアビディティ(avidity,結合力)検査やPCR法による検査は未承認であり、今後の確立が求められる。
- 後天性トキソプラズマ症
- (1) 急性感染
健康成人または小児が後天的にトキソプラズマに感染した場合、多くは無症状で経過する。発症した場合、発熱や倦怠感やリンパ節腫脹などの非特異的な一過性の症状が起こり、時に伝染性単核症様の病態を呈する。通常、特異的IgGとIgMの抗体価測定により血清学的な診断を行う。
- (2) 眼トキソプラズマ症
眼に孤発して発症する。先天性感染の再活性化で生じることが多く、後天性感染で発症することは稀である。症状としては、視力障害、眼痛、羞明などが見られる。
- (3) 日和見トキソプラズマ感染症
免疫不全者では、体内に潜伏感染していたトキソプラズマが再活性化し、脳炎や肺炎や脈絡網膜炎などの重篤な症状を引き起こす。トキソプラズマ脳炎の臨床症状としては意識障害、けいれん、視力障害などがあげられる。また、頭部造影CTやMRIで、病変はリング状に造影される腫瘤として認められる。
トキソプラズマ脳炎の診断は、PCRによる髄液からの原虫遺伝子の検出によるが、感度が低く、陰性であっても感染は否定されない。
治療
2012年11月現在、海外で使用されるピリメタミンやスルファジアジンなどは日本では未承認となっている。また、スピラマイシンの類薬であるアセチルスピラマイシンなどの国内承認薬もトキソプラズマ症が適応症となっていない。そのため、適応外使用や個人輸入により治療が行われており、今後国内での開発が期待される。海外での実際は
文献12に詳しい。
疫学
- トキソプラズマ症の疫学
前述の宮崎県における妊婦の抗体検査による調査結果では、0.25%が妊娠期間中にトキソプラズマ抗体が陰性から陽性へと陽転しており、妊娠中のトキソプラズマ感染が推定された11)。先天性トキソプラズマ症の発生が疑われるが、前述の通り、不顕性遅発性の先天性感染は妊娠中や出生時の画像や肉眼所見による診断が困難であり、検査の確立やフォローが課題となっている。
また、トキソプラズマはHIV感染者に致死的な脳炎を引き起こして患者を死に至らしめることが知られており、アメリカでの統計によるとHIV感染患者の18-25%がトキソプラズマ脳炎を発症することが報告されており13)、本症で死亡するHIV感染者は米国で全患者の10%、欧州では30%に及ぶとされる14)。また、CD4細胞数が100/mm3以下に低下したHIV感染者の約30%にトキソプラズマの再燃が見られたとの報告もある。本邦においては、2011年までの日本国籍AIDS
患者累計(5,158 件)において、トキソプラズマ脳症は94例(1.8%)報告されている15)。
- トキソプラズマ原虫の分子疫学
トキソプラズマは遺伝的な多様性が非常に低いことが知られている。本原虫の分子疫学は欧州と北米地域で詳細に調査されており、これらの地域に流布するトキソプラズマは3種のクローン(I〜III型)にほぼ限定されることが報告されている16)。これらのクローンは約1万年前に出現したと推定されており、またその時期は人類が農耕や牧畜を始めた時期とほぼ一致することから、これらの3クローンは人類の農耕や牧畜に対して何かしらの有利な形質を持っており、人類社会の周辺に適応、選択されたのではないかとの仮説が提唱されている。また、各クローンはヒトやマウスに対する病原性やその分離される場所が異なることが知られている。Ⅰ型のトキソプラズマは強毒性系統であり、先天性感染などの急性感染患者から分離される。マウスのLD100(100%致死量)は100、すなわち1である。Ⅱ型は弱毒性系統であり、ヒトではAIDS患者など慢性感染の患者から分離され、マウスのLD50は103以上である。Ⅲ型は主に家畜から分離され、マウスに対する毒性は非常に低く、基本的に無毒であることが知られている。
しかしながらこれらのトキソプラズマ分子疫学は欧米のヒトおよび家畜を対象としたものが大半であり、その他の地域や野生動物におけるトキソプラズマの分布と系統に関わる情報はほとんど明らかになっていない。事実、南米のトキソプラズマの遺伝的多様性は北米および欧州地域に比べ大きく異なっていることや17)、北米には主に野生動物に感染する新たな第4番目のサブタイプが存在し、ヒトへの感染源になり得ること18)など、最近新たな知見が次々と見出されている。このような中で日本を含むアジア地域におけるトキソプラズマの詳細な分子疫学調査はほとんど行われておらず、感染経路を含む感染の実数調査および病原性と分子系統の詳細な解析が望まれる。特に我が国は欧米諸国と地理的に隔てられており、また生肉嗜好性など食習慣も欧米人とはかなり異なっているので、欧米で用いられている遺伝子多型による病原性判定が適用可能かについても再確認が必要であるものと考えられる。
引用文献
1) 川名尚、小島俊行:母子感染, 金原出版, 2011
2) Dubey, J.P.: The history and life
cycle of Toxoplasma gondii. in: Toxoplasma gondii (Weiss, L.M. and Kim,
K. ed.) , Academic Press, 2007
3) 喜屋武尚子、松原立真、永宗喜三郎:トキソプラズマ症と沖縄県におけるトキソプラズマの流行状況について.防菌防黴(印刷中)
4) Dubey, J.P., Kotula, A.W., Sharar, A.,
Andrews, C.D., Lindsay, D.S.: Effect of high temperature on infectivity
of Toxoplasma gondii tissue cysts in pork. J. Parasitol. 76: 201-204,
1990
5) Kotula, A.W., Dubey, J.P., Sharar,
A.K., Andrews, C.D., Shen, S.K., Lindsay, D.S.: Effect of freezing on
infectivity of Toxoplasma gondii tissue cysts in pork. J. Food
Protection 54: 687-690, 1991
6) Lunden, A., Uggla, A.: Infectivity of
Toxoplasma gondii in mutton following curing, smoking, freezing or
microwave cooking. Int. J. Food Microbiol. 15: 357-363, 1992
7) Heukelbach, J., Meyer-Cirkel, V.,
Moura, R.C., Gomide, M., Queiroz, J.A., Saweljew, P., Liesenfeld, O.:
Waterborne toxoplasmosis, northeastern Brazil. Emerg. Infect. Dis. 13:
287-289, 2007
8) Bowie, W.R., King, A.S., Werker, D.H.,
Isaac-Renton, J.L., Bell, A., Eng, S.B., Marion, S.A.: Outbreak of
toxoplasmosis associated with municipal drinking water. Lancet 350:
173-177, 1997
9) Benenson, M.W., Takafuji, E.T., Lemon,
S.M., Greenup, R.L., Sulzer, A.J.: Oocyst-transmitted toxoplasmosis
associated with ingestion of contaminated water. New Engl. J. Med. 307:
666-669, 1982
10) Frenkel, J.K., Dubey, J.P.: Effects of freezing on the viability of toxoplasma oocysts. J. Parasitol. 59: 587-588, 1973
11) Sakikawa, M., Noda, S., Hanaoka, M.,
Nakayama, H., Hojo, S., Kakinoki, S., Nakata, M., Yasuda, T., Ikenoue,
T., Kojima, T.: Anti-Toxoplasma Anitibody Prevalence, Primary Infection
Rate, and Risk Factors in a Study of Toxoplasmosis in 4,466 Pregnant
Women. Clin. Vaccine Immunol. 19: 365-367, 2012
12) Montoya, J.G., Liesenfeld, O.: Toxoplasmosis. Lancet 363: 1965-1976, 2004
13) Kasper, L.H., Buzoni-Gatel, D.: Some
opportunistic parasitic infections in AIDS: candidiasis,
pneumocystosis, cryptosporidiosis, toxoplasmosis. Parasitol. Today 14:
150-156,1998
14) Hill, D., Dubey, J.P.: Toxoplasma gondii: transmission, diagnosis and prevention. Clin. Microbiol. Infect. 8: 634-640, 2002
15) 平成23年エイズ発生動向年報 http://api-net.jfap.or.jp/status/2011/11nenpo/hyo_11.pdf
16) Howe, D.K., Sibley, L.D.: Toxoplasma
gondii comprises three clonal lineages: correlation of parasite
genotype with human disease. J. Infect. Dis. 172: 1561-1566, 1995
17) Khan,A., Fux, B., Su. C., Dubey,
J.P., Darde, M.L., Ajioka, J.W., Rosenthal, B.M., Sibley, L.D.: Recent
Transcontinental Sweep of Toxoplasma gondii Driven by a single
Monomorphic Chromosome. PNAS 104: 14872-14877, 2007
18) Khan, A., Dubey, J.P., Su, C.,
Ajioka, J.W., Rosenthal, B.M., Sibley, L.D.: Genetic analyses of
atypical Toxoplasma gondii strains reveal a fourth clonal lineage in
North America. Int. J. Parasitol. 41: 645-655, 2011
https://www.niid.go.jp/niid/ja/kansennohanashi/3009-toxoplasma-intro.html


